Video Overlay Titlle
Video Overlay description

Por que usar anticorpos anti-CLDN18 para detectar a CLDN18.2 em amostras tumorais G/JGE?
Os anticorpos anti-CLDN18 podem identificar ambas as isoformas da CLDN18 — CLDN18.1 e CLDN18.2. Entretanto, ao avaliar o tecido tumoral G/JGE, você pode confiar na atribuição da coloração à presença de CLDN18.2 porque2,3:
Preparação de amostras e pré-análise
O manuseio e a preparação apropriados das amostras são essenciais para assegurar a precisão dos resultados de biomarcadores.1
Takeshi Kuwata, MD, PhD

As diretrizes recomendam a manutenção diária do processador de tecidos de acordo com as recomendações do fabricante e a manutenção rigorosa da qualidade dos fluidos do processador, incluindo pH/pureza da formalina e contaminação de álcoois pela água.1
O tempo de isquemia fria deve ser limitado a ≤60 minutos de acordo com as diretrizes atuais.1
As diretrizes fornecem recomendações referentes a dimensões e duração envolvidas na fixação de amostras.1
O tecido deve ser completamente submerso em fixativo
Assegure um razão de volume-massa de tecido não inferior a 4:1, com uma razão ideal de 10:1
A parafina deve ser derretida a <60°C
Amostra contendo tecido tumoral suficiente para análise
Como parte da estabilização, o tecido deve ser fixado em formalina neutra tamponada com fosfato a 10% (pH 7,0) durante pelo menos 6 horas e não mais de 24 a 36 horas
Se o tecido tiver um teor de gordura elevado, a fixação pode demorar até 48 horas
É importante otimizar as variáveis pré-analíticas para minimizar os artefatos de coloração, que podem interferir com a pontuação exata.
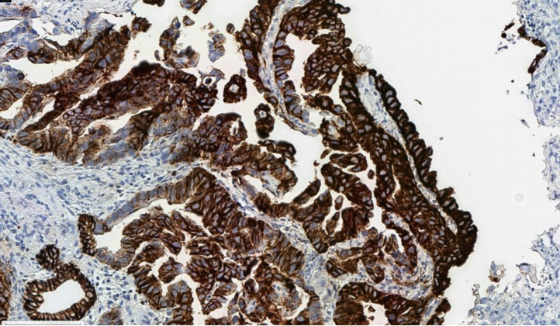
Rubor citoplasmático devido a uma fixação abaixo do ideal, o que pode interferir com a pontuação membranosa exata.
Os tecidos processados por rotina, fixados em formalina e incluídos em parafina (FFPE) são adequados para utilização em testes de IHC
Os espécimes que são aspirados por agulha fina (FNA), espécimes citológicos ou lesões ósseas metastáticas não são elegíveis para a coloração de CLDN18.2
As seções de tecido podem ser cortadas a 3 µm-6 µm*
Antes da coloração, as lâminas cortadas devem ser completamente secas à temperatura ambiente (secas naturalmente)
ou por cozedura desconectada (cozidas no forno) a 60°C durante 60 minutos*
Para garantir a integridade dos espécimes, as áreas de armazenamento devem ser:
Secas
Livres de pragas
Em temperatura ambiente (18°C a 25°C)

Estão disponíveis diversos ensaios, anticorpos e plataformas para a avaliação da expressão de CLDN18.2. Os ensaios e anticorpos incluem o Ensaio IVD VENTANA CLDN18 (43-14A), o Anticorpo LSBio PathPlus™ CLDN18 e o Anticorpo Recombinante Anti-Claudina 18 (43-14A). As opções para plataformas incluem BenchMark ULTRA, Dako Autostainer e Leica Bond.4
A lista de anticorpos/ensaios e plataformas não é exaustiva, e os testes mencionados acima não são todos diagnósticos complementares aprovados pela Agência Nacional de Vigilância Sanitária (ANVISA). Recomendamos que avalie as especificações e utilize o teste adequado para orientar a tomada de decisões clínicas.
Ensaio VENTANA CLDN18
(43-14A) IVDSaiba mais
Anticorpo LSBio PathPlusTM
CLDN18Saiba mais
Anticorpo anti-Claudina 18 recombinante Abcam (43-14A)Saiba mais
Christoph Röcken, MD
São essenciais controles adequados para a detecção de CLDN18.2 em amostras de tumores G/JGE. Seguem-se alguns pontos-chave sobre a sua seleção e utilização.2,5
As diretrizes recomendam que os laboratórios validem e/ou verifiquem os testes imuno-histoquímicos antes de os colocarem ao serviço clínico e devem incluir tecidos positivos, negativos e limítrofes, refletindo a utilização pretendida do ensaio.5
Os controles de tecidos estão disponíveis comercialmente através de vários fornecedores:
CAP PPMPT, Equipe do Projeto de Pré-análise para Medicina de Precisão do College of American Pathologists; CLDN, claudina; CLDN18.1, claudina 18 isoforma 1; CLDN18.2, claudina 18 isoforma 2; FDA, Administração de Alimentos e Medicamentos dos EUA; G/JGE, gástrico/junção gastroesofágica; IHC, imuno-histoquímica; IVD, diagnóstico in vitro.
Em um estudo que avaliou a reprodutibilidade e comparabilidade de três anticorpos anti-CLDN18 e plataformas de coloração IHC numa coorte de 27 laboratórios globais4,*,†:
*Os anticorpos no estudo incluíram o ensaio VENTANA CLDN18 (43-14A) IVD da Roche Tissue Diagnostics, o anticorpo anti-CLDN18 PathPlus™ da LSBio e o Anticorpo Anti-claudina-18 da Novus Biologicals. As plataformas incluíam BenchMark ULTRA, Dako Autostainer e Leica Bond.4
†As pontuações de referência de consenso de todos os anticorpos para cada amostra foram determinadas pela revisão patológica central. A positividade para CLDN18.2 foi definida com um limiar de ≥75% de células tumorais que expressam CLDN18 membranosa com intensidade de coloração moderada a forte (≥2+). Desse modo, os patologistas participantes foram obrigados a submeter uma chamada binária positiva/negativa, bem como uma estimativa da porcentagem de células coradas. As pontuações de IHC submetidas em laboratório foram comparadas com a pontuação de consenso de referência e consideradas discordantes se o resultado binário positivo/negativo fosse diferente. Foi realizada análise estatística para comparação e aplicado critério de aceitação de 85% (≥0,85).4

As diretrizes recomendam o teste de todos os biomarcadores acionáveis disponíveis, como o HER2, no momento do diagnóstico, se houver suspeita ou documentação de câncer gástrico metastático.6
As diretrizes da ESMO recomendam testes para CLDN18.2.6
Qualquer novo biomarcador deve ser testado simultaneamente com outros biomarcadores para permitir a comunicação oportuna dos resultados.6,7
Numa coorte de pacientes com câncer avançado compreendendo diversos tipos de câncer (N=1423), a implementação de um protocolo de teste reflexo no momento do diagnóstico foi associado a uma melhor sobrevida global.7
Vimos evidências de que os testes reflexos melhoram os resultados dos pacientes. É fundamental que os patologistas defendam a realização de testes no momento do diagnóstico para todos os biomarcadores acionáveis e prevalentes.
Matteo Fassan, MD, PhD


Referências: 1. Compton CC, Robb JA, Anderson MW, et al. Preanalytics and precision pathology: pathology practices to ensure molecular integrity of cancer patient biospecimens for precision medicine. Arch Pathol Lab Med 2019;143(11):1346-63. 2. Ventana CLDN18 (43-14A) assay [package insert]. Mannheim, Germany: Roche Diagnostics GmbH. 3. Sahin U, Koslowski M, Dhaene K, et al. Claudin-18 splice variant 2 is a pan-cancer target suitable for therapeutic antibody development. Clin Cancer Res 2008;14(23):7624-34. 4. Jasani B, Schildhaus HU, Taniere P, et al. Global ring study determining reproducibility and comparability of CLDN18 testing assays in gastric cancer. Pôster apresentado em: ESMO Targeted Anticancer Therapies Congress; March 6-8, 2023; Paris, France. 5. College of American Pathologists. IHC assays—New evidence-based guideline for analytic validation (04-01-2004). https://documents.cap.org/documents/ihc-validation-webinar-handout.pdf. Acessado em 30/03/2023. 6. ESMO Gastric Cancer Living Guidelines (07-2023). https://www.esmo.org/living-guidelines/esmo-gastric-cancer-living-guideline/diagnosis-pathology-and-molecular-biology/article/diagnosis-pathology-and-molecular-biology. Acessado em 07/09/2023. 7. Piening B, Bapat B, Weerasinghe RK, et al. Improved outcomes from reflex comprehensive genomic profiling-guided precision therapeutic selection across a major US healthcare system [Abstract 6622]. J Clin Oncol 2023;41(Suppl 16).